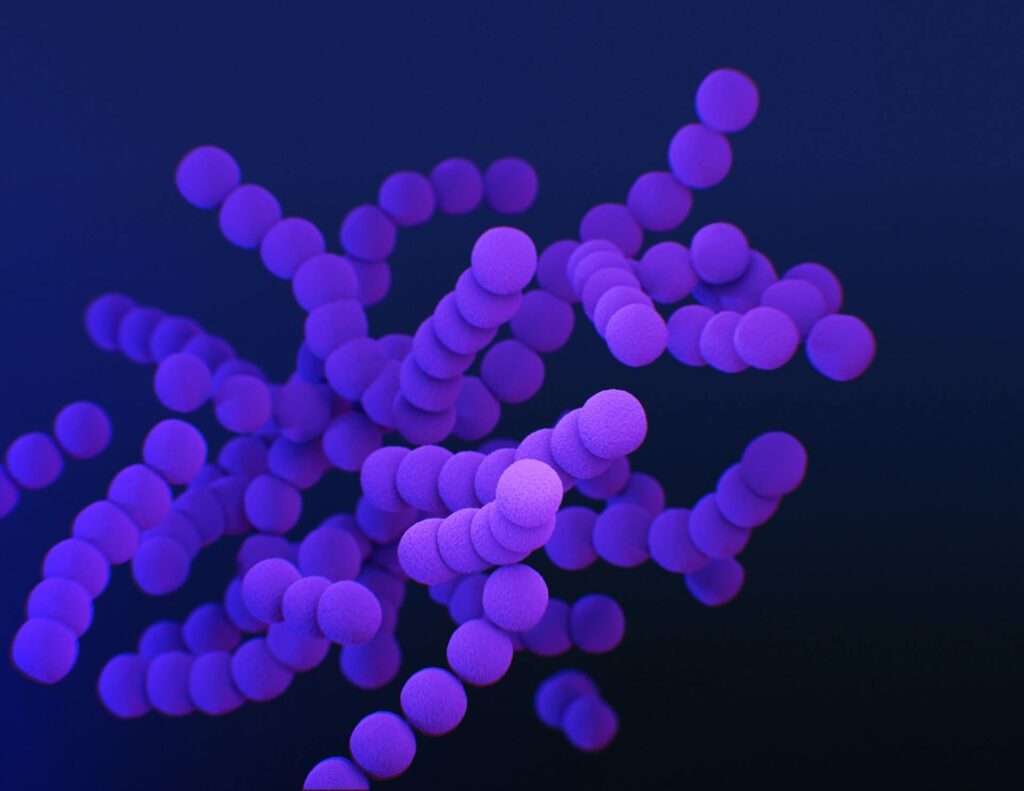
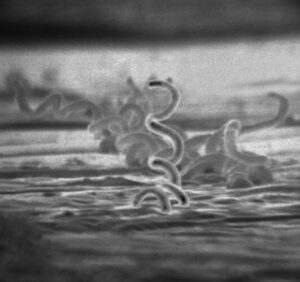
Сифилис — это инфекционное венерическое заболевание, передающееся преимущественно половым путём, вызываемое бактерией Treponema pallidum (бледная трепонема) подвида pallidum, относящимися к роду трепонем (Treponema) порядка Спирохеты (Spirochaetales).
Несмотря на то, что сифилис известен человечеству уже несколько столетий, он остаётся актуальной проблемой современной медицины. Болезнь может поражать практически все органы и системы организма, а её запущенные формы могут привести к серьёзным осложнениям. В этой статье мы расскажем о причинах, симптомах, диагностике и лечении сифилиса.
- Этимология
- История сифилиса
- Классификация
- Эпидемиология
- Пути передачи
- Патогенез
- Клинические проявления заболевания
- Диагностика
- Лечение
Этимология
Считается, что термин «сифилис» впервые был использован итальянским врачом и поэтом Джироламо Фракасторо (1478–1553). В 1530 году он написал поэму на латинском языке под названием «Syphilis, sive Morbus Gallicus» («Сифилис, или французская болезнь»). Это произведение стало ключевым моментом в истории термина.
В поэме рассказывается история пастуха по имени Сифилус (Syphilus), который был наказан богами за свою нечестивость. Согласно сюжету, Сифилус оскорбил бога солнца Аполлона, и тот наслал на него тяжёлое заболевание, поражающее кожу и кости. Это заболевание было описано как аналог современного сифилиса.
В поэме Фракасторо сифилис также называется «Morbus Gallicus», то есть «французская болезнь». Это название связано с историческим контекстом: в конце XV века вспышка сифилиса произошла в Европе после завершения Итальянских войн (1494–1498). Французские войска, вернувшиеся из Италии, принесли с собой заболевание, которое быстро распространилось по всей Европе. Поэтому итальянцы и другие народы называли сифилис «французской болезнью», хотя французы, в свою очередь, называли его «итальянской болезнью».
Существует альтернативная версия, согласно которой название болезни происходит от имени Сифила — одного из сыновей Ниобы. Ниоба, дочь Тантала и супруга Амфиона, царя Фив, была известна своим многочисленным потомством. По некоторым мифам, у неё было четырнадцать детей: семь сыновей и семь дочерей. Возгордившись своей плодовитостью, она позволила себе высмеивать богиню Лето, которая родила лишь двоих детей — Артемиду и Аполлона. За оскорбление матери боги решили наказать Ниобу: Артемида убила её дочерей, а Аполлон — сыновей. Потеряв всех своих детей, Амфион покончил жизнь самоубийством, а Ниоба, поглощённая горем, окаменела, превратившись в скалу. Этот миф был подробно описан римским поэтом Овидием в его знаменитом произведении «Метаморфозы» (I век до н. э. — I век н. э.). В дальнейшем врачи связали образ страдающего героя с заразной болезнью, дав ей имя Сифилус.
История сифилиса
Существуют три основные теории происхождения сифилиса: американская, европейская и африканская.
Американская гипотеза
Одна из наиболее популярных теорий утверждает, что сифилис был завезён в Европу моряками экспедиции Христофора Колумба после их возвращения из Нового Света. Предполагается, что они заразились от коренных жителей Гаити. Многие из этих моряков позже присоединились к армии французского короля Карла VIII, который вторгся в Италию в 1494 году. В 1495 году среди его войск произошла первая крупная вспышка сифилиса во время осады Неаполя. Возможно, именно это стало одной из причин, по которой Карл VIII покинул завоёванное королевство. После поражения его армии испанскими войсками в 1496 году заболевание начало распространяться по Европе вместе с возвращавшимися домой солдатами. Эпидемия охватила Францию, Италию, Германию, Швейцарию, а затем добралась до Австрии, Венгрии и Польши. По оценкам, более 5 миллионов человек погибли от болезни. Основными переносчиками инфекции считались проститутки, обслуживавшие моряков и солдат. К началу XVI века эпидемия распространилась за пределы Европы, достигнув Северной Африки, Турции, Юго-Восточной Азии, Китая и Индии. В 1512 году в Киото произошла массовая вспышка заболевания. В эпоху Возрождения сифилис стал одной из главных причин смертности.
Критики этой гипотезы указывают на археологические находки скелетов с признаками сифилитического поражения, датируемых более ранним периодом. Однако исследования под руководством Кристин Харпер из Университета Эмори, проведённые с использованием генетического анализа, подтвердили связь бледной трепонемы — возбудителя сифилиса — с южноамериканскими трепонемами. Учёные объясняют находки средневековых скелетов с признаками сифилиса действием другого штамма трепонемы, который, вероятно, пришёл из Африки и не передавался половым путём.
Эту гипотезу дополнительно подкрепило исследование Института эволюционной антропологии Общества Макса Планка в 2024 году. Палеогенетики проанализировали останки восьмидесяти древних жителей Нового Света, умерших до прибытия Колумба. В пяти образцах были обнаружены фрагменты ДНК бледной трепонемы и родственных микробов. После расшифровки их геномов учёные сравнили данные с современными штаммами и пришли к выводу, что все современные разновидности трепонем произошли из одного источника в Новом Свете и распространились в другие регионы около конца XV века.
Европейская гипотеза
Согласно этой теории, сифилис существовал в Европе задолго до эпохи Возрождения. Сторонники гипотезы ссылаются на труды античных учёных, таких как Гиппократ, Гален, Диоскорид, Цельс и Авиценна, где описаны симптомы, напоминающие сифилис. Также упоминаются библейские тексты, в которых описываются кожные и костные поражения, характерные для этого заболевания.
Археологические находки также подтверждают эту версию. Например, скелеты монахов-августинцев, живших в монастыре английского города Кингстон-апон-Халла, показывают повреждения костей, которые могут быть связаны с сифилисом. Радиоуглеродный анализ датирует их средневековым периодом. В судоходных журналах того времени упоминается частое прибытие моряков из дальних стран, что могло способствовать распространению болезни. В скелетах жителей древнего города Помпеи также обнаружены признаки врождённого сифилиса, хотя интерпретация этих данных остаётся спорной. Кроме того, найден скелет подростка XIV века с изменениями зубов, характерными для внутриутробного заражения сифилисом.
Африканская гипотеза
Ещё одна теория предполагает, что сифилис зародился в Африке. Она была впервые выдвинута в 1961 году Т. Кокбёргом и в 1963 году поддержана Э. Хадсоном. Согласно этой гипотезе, возбудители сифилиса и других тропических трепонематозов (таких как фрамбезия, пинта и беджель) имеют общего предка, который, вероятно, исчез в наши дни. Заболевание распространилось из Африки благодаря войнам, торговым связям и работорговле.
Гипотеза о связи с гонореей
Значительную путаницу в понимание природы сифилиса внесла экспериментальная работа шотландского хирурга Джона Хантера. В 1767 году он провёл рискованный эксперимент, пытаясь доказать, что сифилис и гонореяГонорея (от др.-греч. γόνος — «семя» и ῥέω — «течь»; в просторечии также известна как перелой или триппер) — инфекционное заболевание, вы More — это проявления одного заболевания. Для этого Хантер привил себе в область головки полового члена и крайнюю плоть гной, взятый у пациента с гонореей. Спустя несколько недель на месте прививки появился твёрдый шанкр — классический признак сифилиса. Этот результат казался настолько убедительным, что более века в медицине господствовало мнение о совместной природе этих двух заболеваний.
Однако на самом деле опыт Хантера был ошибочным из-за стечения обстоятельств: пациент, от которого был взят материал, страдал одновременно и сифилисом, и гонореей. Это фундаментальное недоразумение лишь спустя десятилетия было раскрыто благодаря исследованиям французского учёного Филиппа Рикора.
Уже в 1792 году шотландский врач Бенджамин Белл пытался опровергнуть выводы Хантера, утверждая, что сифилис и гонореяГонорея (от др.-греч. γόνος — «семя» и ῥέω — «течь»; в просторечии также известна как перелой или триппер) — инфекционное заболевание, вы More — это совершенно разные заболевания. Однако его доводы не получили широкого признания до середины XIX века.
Лишь через 60–70 лет после эксперимента Хантера ситуация начала проясняться благодаря масштабным, но этически сомнительным исследованиям Филиппа Рикора. В период с 1831 по 1837 год он заразил 700 человек сифилисом и 667 — гонореей. Большинство участников экспериментов были заключёнными, приговорёнными к смерти. Хотя методы Рикора вызвали осуждение научного сообщества, его данные оказались бесценными для окончательного разрешения спора между «унитаристами» (утверждающими, что сифилис и гонореяГонорея (от др.-греч. γόνος — «семя» и ῥέω — «течь»; в просторечии также известна как перелой или триппер) — инфекционное заболевание, вы More — одно заболевание) и «дуалистами» (считавшими их разными болезнями). Результаты Рикора подтвердили, что сифилис и гонореяГонорея (от др.-греч. γόνος — «семя» и ῥέω — «течь»; в просторечии также известна как перелой или триппер) — инфекционное заболевание, вы More вызываются разными возбудителями и имеют принципиально различную природу.
Таким образом, ошибочные выводы Джона Хантера задержали прогресс в изучении сифилиса на целое столетие. Лишь благодаря последующим исследованиям учёных, таких как Рикор, истинная природа этих заболеваний была окончательно установлена.
Классификация
В целом все случаи заболевания сифилисом можно разделить на следующие группы:
- Первичный сифилис
- Вторичный сифилис
- вторичный ранний сифилис
- вторичный поздний сифилис
- Третичный сифилис
- Врождённый сифилис
Согласно данной, традиционной клинической классификации все формы сифилиса разделяются на ранние и поздние формы. Для ранних форм характерны высокая степень контагиозности, реакция Вассермана с яркоположительным результатом (++++) и бесследное разрешение сифилидов, для поздних — меньшая контагиозность, калечащие сифилиды, поражающие и необратимо разрушающие не только кожу и слизистые, но также скелет, внутренние органы (сифилитическая эктима, рупия, гумма) и ЦНС, и малая степень выраженности реакции Вассермана (+, редко ++). Для врождённого сифилиса характерны те же черты, что для позднего сифилиса в сочетании с пренатальным поражением и недоразвитием органов и систем.
Существует расширенная клинико-лабораторная классификация, которая учитывает не только временные этапы проявления клинических форм, но и специфику изменений классических серологических реакций на различных стадиях развития сифилиса.
- Сифилис первичный сероотрицательный.
- Сифилис первичный сероположительный.
- Вторичный свежий сифилис.
- Вторичный скрытый сифилис.
- Вторичный рецидивный сифилис.
- Третичный активный сифилис.
- Третичный скрытый сифилис.
- Скрытый сифилис.
- Сифилис плода.
- Ранний врождённый сифилис.
- Поздний врождённый сифилис.
- Скрытый врождённый сифилис.
- Висцеральный сифилис.
- Сифилис нервной системы.
Международная классификация болезней выделяет следующие формы сифилиса:
- A50 Врождённый сифилис
- A50.0 Ранний врождённый сифилис с симптомами
- A50.1 Ранний врождённый сифилис скрытый
- A50.2 Ранний врождённый сифилис неуточнённый
- A50.3 Позднее врождённое сифилитическое поражение глаз
- A50.4 Поздний врождённый нейросифилис [ювенильный нейросифилис]
- A50.5 Другие формы позднего врождённого сифилиса с симптомами
- A50.6 Поздний врождённый сифилис скрытый
- A50.7 Поздний врождённый сифилис неуточнённый
- A50.9 Врождённый сифилис неуточнённый
- A51 Ранний сифилис
- A51.0 Первичный сифилис половых органов
- A51.1 Первичный сифилис анальной области
- A51.2 Первичный сифилис других локализаций
- A51.3 Вторичный сифилис кожи и слизистых оболочек
- A51.4 Другие формы вторичного сифилиса
- A51.5 Ранний сифилис скрытый
- A51.9 Ранний сифилис неуточнённый
- A52 Поздний сифилис
- A52.0 Сифилис сердечно-сосудистой системы
- A52.1 Нейросифилис с симптомами
- A52.2 Асимптомный нейросифилис
- A52.3 Нейросифилис неуточнённый
- A52.7 Другие симптомы позднего сифилиса
- A52.8 Поздний сифилис скрытый
- A52.9 Поздний сифилис неуточнённый
- A53 Другие и неуточнённые формы сифилиса
- A53.0 Скрытый сифилис, неуточнённый как ранний или поздний
- A53.9 Сифилис неуточнённый
Эпидемиология
Сифилис, впервые описанный в конце XV века, с момента своего появления стал серьёзной социальной проблемой и остаётся таковой до сих пор. На протяжении долгого времени основным способом борьбы с распространением болезни в Европе был строгий контроль за проститутками, которых обязывали регулярно проходить медицинский осмотр. Начиная с XVI века в странах Европы, таких как Италия и Франция, стали создаваться специальные приюты для больных сифилисом. Позже, в XIX веке, некоторые из этих учреждений трансформировались в центры по исследованию венерических заболеваний.
К началу XXI века в развитых странах количество выявленных случаев первичного и вторичного сифилиса остаётся на относительно стабильном уровне. Однако наблюдается рост числа заражений через оральный половой контакт. По имеющимся данным, от 20 процентов до 30 процентов пациентов со впервые диагностированным сифилисом заразились именно таким путём. При этом эксперты полагают, что реальные цифры могут быть выше, поскольку официальная статистика не всегда отражает полную картину.
В России ситуация с заболеваемостью сифилисом значительно ухудшилась после распада СССР. Если в 1991 году на 1 миллион человек приходилось 71 заболевший, то к 1998 году этот показатель увеличился до 272 случаев на 1 миллион населения. В 2009 году заболеваемость достигла 522 человек на 1 миллион жителей, что в 7,2 раза превышает уровень 1991 года.
Пути передачи
Особенности передачи сифилиса определяются биологическими характеристиками его возбудителя — бледной трепонемы, которая крайне чувствительна к условиям окружающей среды, таким как влажность и температура, а также является анаэробным микроорганизмом.
Основной путь распространения сифилиса — половой контакт. Это заболевание классифицируется как венерическое наряду с такими болезнями, как гонореяГонорея (от др.-греч. γόνος — «семя» и ῥέω — «течь»; в просторечии также известна как перелой или триппер) — инфекционное заболевание, вы More, мягкий шанкр и другие инфекции, передающиеся половым путём. Однако возможны и другие механизмы заражения. Например, инфекция может передаваться через кровь: при переливании заражённой крови, использовании общих игл или ёмкостей для растворов среди лиц, употребляющих наркотики внутривенно. В быту риск заражения существует при использовании предметов, контактирующих с кровью, таких как зубные щётки, бритвы или маникюрные инструменты.
Бытовой «бескровный» путь передачи сифилиса считается редким, но теоретически возможным. Он требует тесного контакта с больным на поздних стадиях заболевания, когда наблюдаются открытые язвы или распадающиеся гуммы, выделяющие возбудителя. В таких случаях инфекция может попасть на предметы обихода, например, посуду, полотенца, ложки или бельё, которые затем контактируют со слизистыми оболочками здорового человека. Однако способность мочи и пота больного передавать инфекцию не подтверждена научно, а в слюне бледная трепонема обнаруживается только при наличии сифилитических высыпаний в ротовой полости.
Кроме того, возможно заражение ребёнка через грудное молоко матери, даже если нет видимых изменений на молочной железе. Сперма больного также может быть источником инфекции, даже при отсутствии явных поражений на половом члене. Медицинский персонал находится в группе риска при выполнении лечебных или диагностических процедур, особенно при работе с трупами пациентов, умерших от сифилиса. Особую опасность представляют тела детей с врождённой формой заболевания.
Патогенез
Продолжительность инкубационного периода при первичном сифилисе в среднем составляет около 3 недель, однако этот временной интервал может варьироваться от нескольких дней до 6 недель с момента инфицирования. После завершения инкубационного периода, если заражение произошло половым или бытовым путём, в месте внедрения возбудителя обычно формируется первичный очаг поражения, известный как первичный аффект.
Механизм развития сифилиса связан с реакцией организма на токсическое воздействие бледной трепонемы. Токсигенные свойства возбудителя определяют разнообразие патологических процессов, протекающих в организме. Характер и выраженность изменений зависят от стадии заболевания, что приводит к значительным различиям в клинической картине на разных этапах болезни.
Классическое течение сифилитической инфекции подразделяется на четыре последовательных периода:
- Инкубационный;
- Первичный;
- Вторичный;
- Третичный.
Первые три периода сопровождаются специфическими проявлениями, тогда как инкубационный период протекает бессимптомно. Его длительность можно установить только ретроспективно, после появления первых клинических признаков заболевания.
Инкубационный период
Инкубационный период сифилиса охватывает время от момента проникновения бледной трепонемы в организм до появления первичного аффекта, который проявляется в виде твёрдого шанкра и сопровождается регионарным лимфаденитом. В этот период происходит постепенное накопление возбудителя в месте его внедрения. Бледная трепонема размножается путём деления, в среднем один раз за 30–32 часа.
Этот этап болезни протекает бессимптомно: клинические и серологические изменения отсутствуют. Продолжительность инкубационного периода в среднем составляет 3–4 недели, однако она может варьироваться. В некоторых случаях период сокращается до 8–15 дней или удлиняется до 108–190 дней. Укорочение срока часто наблюдается при одновременном заражении из двух источников, тогда как его увеличение может быть связано с приёмом антибиотиков после инфицирования, например, для лечения ангины. Однако стоит отметить, что удлинение инкубационного периода не всегда обусловлено воздействием антибактериальных препаратов.
Первичный сифилис
С момента появления твёрдого шанкра начинается первичный период сифилиса, который продолжается до возникновения специфической сыпи на коже и слизистых оболочках. Обычно этот этап заболевания длится около 6–7 недель. Примерно через 5–8 дней после формирования шанкра у пациента начинают увеличиваться регионарные лимфатические узлы, что сопровождается развитием специфического бубона (регионарного склераденита). Однако во второй половине XX века учёные отметили изменение клинической картины: всё чаще стали встречаться случаи, при которых регионарное увеличение лимфоузлов отсутствовало. Если в начале XX века такие случаи наблюдались лишь у 0,06 процентов больных, то к 1976 году, согласно данным Е. М. Костиной, их доля выросла до 21,6 процентов. Кроме того, лимфаденит часто сочетается с воспалением лимфатических сосудов (лимфангитом).
Ранее первичный сифилис подразделяли на два периода: серонегативный и серопозитивный. В серонегативном периоде классические серологические реакции (КСР), такие как реакция Вассермана, Колмера, Кана, Закса-Витебского, дают отрицательный результат. В серопозитивном периоде эти тесты становятся положительными, что обычно происходит спустя 3–4 недели после появления первичной сифиломы. Если хотя бы одна из серологических реакций оказывается положительной, диагностируется первичный серопозитивный сифилис. Такое разделение использовалось для оценки времени, в течение которого инфекция находилась в организме.
Однако с середины 1980-х годов и по настоящее время значение этого разделения значительно снизилось благодаря внедрению современных высокоспецифичных и чувствительных методов диагностики, таких как ПЦР (полимеразная цепная реакция), ИФА (иммуноферментный анализ), а также РИФ (реакция иммунофлуоресценции) и РИБТ (реакция иммобилизации бледной трепонемы). Эти методы позволяют выявлять специфические антитела к антигенам бледной трепонемы, в частности иммуноглобулины классов M и G, в те же сроки, что и при контакте с другими антигенами. Таким образом, современные технологии сделали разделение на серонегативный и серопозитивный период менее актуальным.
Вторичный сифилис
Вторичный сифилис характеризуется преимущественно гематогенным (через кровь) распространением бледной трепонемы по организму, что приводит к появлению высыпаний на коже и слизистых оболочках, а также к поражению нервной системы.
Этот период болезни подразделяется на три основные формы:
- Свежий вторичный сифилис (Lues secundaria recens), или ранний;
- Рецидивный вторичный сифилис (Lues secundaria recidiva), или возвратный (Lues secundaria reccurens);
- Скрытый вторичный сифилис (Lues secundaria latens).
Обычно вторичный сифилис начинается через 6–7 недель после появления первичной сифиломы или спустя 9–10 недель после заражения. Гематогенное распространение возбудителя вызывает системное поражение организма, что проявляется специфической сыпью: розеолёзной, папулёзной или пустулёзной. Помимо кожи и слизистых, страдают внутренние органы и системы, включая нервную систему, кости, печень и почки.
Высыпания на коже возникают вследствие активного иммунного ответа, который разрушает трепонемы, высвобождая эндотоксины с ангиопаралитическим действием. Эти высыпания через несколько недель исчезают бесследно, и заболевание переходит в скрытую фазу.
В этот период возбудитель сохраняется в организме в подавленном состоянии, его размножение ограничивается иммунной системой. Однако иммунитет не способен полностью устранить хронические очаги инфекции, локализованные в тканях и органах. При снижении иммунной защиты возможны рецидивы заболевания. Рецидивы вторичного сифилиса могут повторяться многократно, причём их характерной особенностью является увеличение размеров элементов сыпи и их склонность к слиянию в обширные очаги.
Начиная с конца XX века клиническая картина вторичного сифилиса значительно изменилась. В настоящее время часто бывает сложно отличить свежий вторичный сифилис от рецидивного только по клиническим признакам. Это связано с патоморфозом заболевания и широким использованием антибиотиков в повседневной жизни, что влияет на течение инфекции и её проявления.
Третичный сифилис
Третичный сифилис развивается примерно у 30 процентов пациентов, которые не получили лечения. Как правило, это происходит спустя 10–20 лет после бессимптомной хронической стадии заболевания. На этом этапе эффективность иммунного ответа постепенно снижается, что приводит к системному поражению всех органов и тканей организма.
Главной особенностью третичного сифилиса является грубое разрушение структуры поражённых органов и тканей. На коже и во внутренних органах формируются специфические образования — сифилитические гуммы. Заболевание протекает циклически, а обострения часто провоцируются факторами, ослабляющими иммунитет, такими как травмы, инфекции, стрессовые ситуации или недостаточное питание.
Если в течение 10–20 лет после начала третичного периода больной не получает адекватного лечения, начинается специфическое поражение различных систем организма. Примерами таких поражений являются нейросифилис (включая прогрессивный паралич), сифилитическое поражение аорты, сердечных клапанов, костей (особенно большеберцовых), а также развитие сифилитического гонита, увеита, отита и других заболеваний люэтической природы. В то же время поражение почек и печени обычно не имеет специфических особенностей.
Благодаря широкому применению антибиотиков для лечения и регулярным скрининговым обследованиям населения, частота встречаемости третичного сифилиса значительно снизилась по сравнению с первой половиной XX века.
Интересным явлением являются случаи, когда у пациентов после завершения первых двух фаз болезни не выявляются ни серологические, ни микробиологические следы возбудителя. В первой половине XX века считалось, что сифилис может излечиваться самопроизвольно. В определённой степени это утверждение верно, поскольку такие люди становятся незаразными и клинические проявления болезни исчезают. Однако дальнейшие исследования показали, что полного очищения организма от инфекции не происходит.
Под воздействием иммунной системы бледная трепонема переходит в L-форму, которая не обнаруживается стандартными серологическими методами, такими как реакция Вассермана. Если иммунный ответ достаточно активен, количество возбудителей снижается настолько, что их выявление становится крайне затруднительным. Таким образом, человек остаётся резервуаром инфекции. При ослаблении иммунитета возбудитель может снова активизироваться, вызывая рецидив заболевания с появлением клинических и серологических признаков.
Механизм иммунного ответа
В современной медицине считается, что врождённого иммунитета к бледной трепонеме не существует, хотя некоторые косвенные данные ставят эту теорию под сомнение. При контакте организма с возбудителем развивается так называемый нестерильный инфекционный иммунитет. Это означает, что организм вырабатывает специфические антитела против бледной трепонемы, однако их недостаточно для полного уничтожения патогена. Теоретически такой иммунный ответ формируется с момента заражения и сохраняется до полного излечения. На практике же в третичном периоде заболевания иммунный ответ может быть настолько слабым, что специфические антитела перестают определяться даже при наличии выраженных клинических проявлений.
В процессе взаимодействия антигенов бледной трепонемы с иммунной системой человека начинают вырабатываться три основные группы антител:
- IgA (флюоресцины) — появляются на ранних этапах заболевания;
- IgM (реагины) — обнаруживаются после формирования твёрдого шанкра;
- IgG (иммобилизины) — вырабатываются позже других групп антител.
Помимо гуморального звена иммунитета (антител), важную роль в борьбе с бледной трепонемой играет клеточный компонент защитной системы. В этом процессе активно участвуют макрофаги, T-лимфоциты и B-лимфоциты.
При типичном фагоцитозе, то есть поглощении чужеродных агентов клетками иммунной системы, выделяют четыре основные стадии:
- Сближение фагоцита и бледной трепонемы — первичное взаимодействие между клеткой иммунной системы и патогеном;
- Прилипание (аттракция) — фиксация возбудителя на поверхности фагоцита;
- Погружение — внедрение бледной трепонемы внутрь протоплазмы фагоцита;
- Внутриклеточное нахождение (переваривание) — окончательное разрушение патогена внутри клетки.
Этот механизм является ключевым в защите организма от инфекции, однако его эффективность в случае сифилиса ограничена, что объясняет хроническое течение заболевания и способность бледной трепонемы длительно сохраняться в организме.
Клинические проявления заболевания
Клинические проявления сифилиса характеризуются значительным разнообразием, которое зависит от стадии болезни. Кроме того, особенности течения заболевания в большой степени обусловлены своевременностью начала терапии, а также её правильностью и систематичностью.
Первичный сифилис
Заболевание начинается с появления первичного очага поражения. Наиболее характерным проявлением является твёрдый шанкр — специфическая безболезненная или слабоболезненная язвочка с ровными краями, гладким дном и плотной структурой. Образование имеет округлую форму, не кровоточит, не увеличивается в размерах и не формирует спутников. Оно возникает как результат иммунной реакции организма на внедрение бледной трепонемы. Помимо классического варианта твёрдого шанкра, возможны атипичные формы: множественный шанкр, индуративный отёк, шанкр-панариций и шанкр-амигдалит.
Индуративный отёк чаще локализуется в области половых органов. Он проявляется увеличением и изменением цвета кожи мошонки, клитора или половых губ. Отмечается застойно-синюшная окраска, которая бледнеет при надавливании, но не оставляет углублений. Болевой синдром обычно отсутствует. Продолжительность состояния составляет от 1–2 недель до месяца. У женщин это явление встречается чаще, чем у мужчин. При отсутствии типичного твёрдого шанкра данное состояние может быть ошибочно принято за другие инфекционно-воспалительные процессы. Диагностика основывается на отсутствии воспалительных изменений в анализе крови и наличии регионарного лимфаденита.
Шанкр-панариций чаще развивается у медицинских работников и напоминает обычный панариций. Как правило, поражаются 1–3-й пальцы правой руки. В отличие от классического твёрдого шанкра, он болезненный и может сочетаться с наличием типичного шанкра на половых органах.
Шанкр-амигдалит локализуется в ротоглотке и проявляется односторонним увеличением нёбной миндалины без дефектов поверхности. Миндалина выпирает в сторону глотки, вызывая затруднение при глотании, боль, лихорадку и общее недомогание. Это состояние во многом напоминает ангину, однако для него характерно одностороннее поражение и обязательное наличие регионарного аденита. Шанкр-амигдалит следует дифференцировать от типичного твёрдого шанкра, так как на поверхности миндалины не образуются язвенные дефекты, а её поверхность остаётся гладкой.
Иногда первичные проявления имеют нетипичный вид, например, выглядят как воспалённая, кровоточащая язвочка с неровными краями и рыхлым дном. Это может быть связано с вторичной бактериальной инфекцией или травмированием язвочки. В таких случаях даже опытные специалисты могут ошибиться в диагностике. Сложность заключается в том, что при первичном сифилисе пациент ещё серонегативен, а бледная трепонема не всегда обнаруживается в материале со дна язвы.
Обязательным симптомом первичного аффекта является регионарный лимфаденит. Лимфатические узлы увеличиваются, становятся плотными, безболезненными и не спаянными с окружающими тканями. Их температура остаётся нормальной, что отличает их от изменений при гнойно-воспалительных заболеваниях. В редких случаях первичные признаки полностью отсутствуют, если возбудитель попадает непосредственно в кровоток (например, при переливании инфицированной крови). Такое течение называют обезглавленным сифилисом. Его необходимо дифференцировать от случаев, когда первичный очаг существует, но трудно диагностируется из-за локализации в труднодоступных местах, например, на шейке матки. В таких ситуациях заболевание может казаться начавшимся сразу со вторичной стадии (бактериемической) или даже с хронической латентной формы.
Первичные признаки исчезают бесследно через несколько дней или недель. В конце серонегативного периода, особенно ближе к его завершению, пациенты могут отмечать недомогание, слабость, головокружение и повышение температуры. После этого развивается вторичная стадия сифилиса, характеризующаяся бактериемией.
Вторичный сифилис
На данной стадии заболевания характерны распространённые поражения кожи и слизистых оболочек. Часто высыпания проявляются в виде характерной бледно-пятнистой сыпи, известной как «ожерелье Венеры», или в форме множественных мелких кровоизлияний на коже и слизистых. Также могут наблюдаться очаги выпадения волос, иногда приводящие к полному облысению. Типичным признаком является генерализованный лимфаденит: лимфатические узлы увеличиваются, становятся плотными, инфильтрированными, но остаются безболезненными или слабоболезненными. Они не спаяны с окружающими тканями и сохраняют «холодную» температуру на ощупь.
На этом этапе пациенты могут испытывать лёгкое недомогание, субфебрильную температуру (около 37°C или немного выше), слабость, а также симптомы воспаления верхних дыхательных путей, такие как кашель или насморк, либо признаки конъюнктивита. Однако нередко вторичный сифилис протекает скрытно: характерные высыпания на коже и поражения слизистых могут полностью отсутствовать, а заболевание маскируется под обычную простуду. В таких случаях больной может не заметить симптомов, особенно если первичные проявления остались незамеченными. В некоторых случаях вторичная стадия вообще не выражена: нет ни сыпи, ни температуры, ни катаральных явлений, и болезнь сразу переходит в хроническую форму.
Стадия сифилитической бактериемии, или вторичный сифилис, обычно продолжается несколько дней, редко затягиваясь более чем на 1–2 недели. Постепенно пятнистая сыпь бледнеет и исчезает, параллельно ослабевают и уходят симптомы воспаления верхних дыхательных путей, проходят слабость и общее недомогание.
Ранний нейросифилис
Клинические признаки раннего нейросифилиса обычно проявляются в течение первых 2–3 лет после инфицирования и совпадают по времени со вторичной стадией заболевания. На патоморфологическом уровне для раннего нейросифилиса характерно поражение сосудов и оболочек головного мозга. В мозговых оболочках наблюдаются признаки пролиферативного воспаления, а в сосудах развивается гиперплазия интимы с образованием вокруг них множественных гумм.
Наиболее распространённым проявлением раннего нейросифилиса является хронический сифилитический менингит. Один из ключевых диагностических признаков, отличающих его от менингитов другой природы, — это симптом Аргайля-Робертсона. Он проявляется сохранением реакции зрачков на аккомодацию и конвергенцию, но нарушением их реакции на свет.
Среди менее распространённых форм раннего нейросифилиса выделяют менинговаскулярный сифилис, сифилитические невриты и полиневриты, а также менингоэнцефалит сифилитической этиологии.
Клиническая картина раннего нейросифилиса определяется локализацией поражений и во многом напоминает инфекционно-воспалительные заболевания головного мозга, вызванные другими причинами.
Третичный сифилис
После вторичной стадии наступает скрытая, или латентная, хроническая фаза сифилиса. Этот этап может продолжаться месяцами, годами, а иногда и десятилетиями (10–20 лет или более). У части нелеченных пациентов заболевание остается в этой форме на всю жизнь: они становятся бессимптомными носителями бледной трепонемы, не демонстрируя признаков третичного сифилиса. Однако примерно у 30 процентов больных, не получивших лечения, после периода скрытой инфекции развивается третичный сифилис. На этом этапе наблюдаются множественные деструктивные изменения в различных органах и системах организма.
Третичный сифилис характеризуется поражением аорты (сифилитический аортит), головного мозга (прогрессивный паралич), спинного мозга (спинная сухотка, или tabes dorsalis ), крупных сосудов (сифилитический эндартериит), костно-мышечной системы, кожи и слизистых оболочек. Вследствие персистирующих очагов хронической инфекции формируются гуммы — мягкие опухолевидные образования, которые со временем трансформируются в плотные фиброзные рубцы.
Врожденный сифилис
Сифилис способен передаваться плоду через плаценту от инфицированной матери. Врождённый сифилис имеет особенности течения, которые отличаются от классической формы заболевания. Это связано с воздействием бледной трепонемы на ткани развивающегося плода, вызывая многочисленные структурные изменения, проявляющиеся характерными врождёнными аномалиями.
Для врождённого сифилиса типична следующая триада признаков:
- паренхиматозный кератит;
- врождённая глухота;
- нарушение развития зубов (так называемые зубы Гетчинсона).
Особую опасность врождённого сифилиса составляет то, что даже после полной эрадикации возбудителя из организма необратимые изменения остаются. Это существенно ухудшает качество жизни пациента и часто становится причиной инвалидности.
Считается, что бледная трепонема не способна поражать плод до 16 недель беременности, поскольку в этот период его иммунная система ещё недостаточно развита для выработки антител в ответ на антиген. Благодаря этому своевременное лечение на ранних сроках беременности может предотвратить заражение плода.
Диагностика
Диагностика сифилиса основывается на данных анамнеза, особенно эпидемиологического (эпиданамнеза), детальном анализе клинической картины и подтверждается лабораторными тестами. Исследуются образцы крови, а в некоторых случаях — спинномозговая жидкость или другие биологические среды пациента. Основными методами выявления и подтверждения заболевания считаются серологическая диагностика и полимеразная цепная реакция (ПЦР).
На сегодняшний день для обнаружения антител к бледной трепонеме широко применяется иммуноферментный анализ (ИФА), который пришел на смену ранее используемой реакции Вассермана. Все диагностические методы разделены на несколько категорий в зависимости от их целей и специфики применения.
- Прямые и непрямые (косвенные);
- Трепонемные (специфические) и нетрепонемные (неспецифические);
- Отборочные (скрининговые) и подтверждающие (диагностические);
- Приборные, бесприборные.
Прямые методы диагностики сифилиса направлены на выявление возбудителя непосредственно в биологическом материале. К таким методам относятся темнопольная микроскопия, заражение лабораторных кроликов, культуральные исследования, а также ПЦР-диагностика.
Наиболее часто применяется комбинация кардиолипинового теста и трепонемного иммуноферментного анализа (ИФА). Если оба этих теста дают положительный результат, это считается подтверждением диагноза сифилиса.
При отрицательных результатах обоих анализов и отсутствии клинических признаков заболевания человек считается здоровым. Если кардиолипиновый тест отрицательный, а ИФА положительный, это может свидетельствовать о ранее перенесенном сифилисе. В случае положительного кардиолипинового теста и отрицательного ИФА рекомендуется повторное исследование, так как такое сочетание может быть связано с особенностями иммунной системы пациента (например, наличием ВИЧ, вирусов гепатита или физиологических изменений, таких как беременность).
Каждый из прямых методов имеет свои ограничения, снижающие их применимость в широкой практике. Темнопольная микроскопия эффективна только на ранних стадиях сифилиса и не позволяет отслеживать динамику лечения. Методика заражения кроликов отличается высокой стоимостью и длительностью выполнения, а также не предоставляет возможности для мониторинга состояния пациента. Культивирование бледной трепонемы на искусственных средах крайне сложно из-за чувствительности возбудителя к условиям окружающей среды. ПЦР-диагностика наиболее эффективна при первичном и вторичном сифилисе, но тест-системы для этого метода остаются дорогими, а исследования его диагностической эффективности продолжаются. Таким образом, прямые методы имеют ограниченное применение в клинической практике, что делает серологические методы основным инструментом диагностики.
Согласно приказу Министерства здравоохранения РФ № 87 от 26.03.2001 «О совершенствовании серологической диагностики сифилиса», для серологической и ликвородиагностики допускается использование следующих реакций:
- Микрореакции преципитации — микроосадочной реакции, МОР (непрямой скрининговый метод);
- Реакции прямой гемагглютинации (РПГА);
- Реакции иммунофлуоресценции (РИФ);
- Реакции иммобилизации бледных трепонем (РИБТ);
- Иммуноферментный анализ не требует отдельной регламентации в связи с чем в приказе № 87 не указан.
Ни один из диагностических методов не обеспечивает абсолютной гарантии выявления возбудителя. Чувствительность используемых тестов колеблется в пределах 90–98 процентов. Для повышения точности диагностики рекомендуется комбинировать два разных метода исследования, что позволяет значительно увеличить достоверность полученных результатов и минимизировать вероятность ошибки.
Лечение
Исторические методы лечения
Первым средством для борьбы с сифилисом стали препараты на основе ртути, включая ртутные мази, предложенные известным врачом Парацельсом. Такие мази наносились преимущественно на ноги.
В 1553 году в труде «Хроника Перу» Сьеса де Леон впервые упомянул растение сассапариль, которое применяли индейцы из региона Гуаякиль (Эквадор) для лечения различных недугов, в том числе сифилиса.
С XVI века для лечения сифилиса использовали смолу южноамериканского дерева гваякум. Хотя её эффект был менее выражен, чем у ртути, она обладала важным преимуществом — отсутствием серьёзных побочных явлений.
Препараты на основе ртути применялись в медицине на протяжении 450 лет, а в СССР они оставались частью клинических рекомендаций до 1963 года. Это объяснялось высокой чувствительностью бледной трепонемы к органическим и неорганическим соединениям, таким как ртуть, мышьяк, висмут и йод, которые блокировали сульфгидрильные группы тиоловых ферментов микроба. Однако такое лечение имело серьёзные недостатки: оно было малоэффективным и крайне токсичным, провоцируя выпадение волос и другие осложнения. Повышение доз препаратов ртути или мышьяка ограничивалось их опасным воздействием на организм пациента. В ходе лечения иногда применялась методика общей меркуризации, когда больного помещали в ёмкость с парами ртути. Несмотря на определённую эффективность, этот способ приводил к высокому риску отравления и постепенно был вытеснен из практики.
Неудовлетворённость результатами меркуризации подтолкнула врачей к поискам новых методов борьбы с заболеванием. Вплоть до второй половины XIX века использовались даже хирургические подходы, такие как иссечение твёрдого шанкра. Однако эксперименты на животных показали, что к моменту появления шанкра возбудитель уже присутствует в крови, что делает эту процедуру бесполезной.
Значительный прогресс в лечении сифилиса произошёл в начале XIX века с внедрением препаратов йода, таких как 2 процентный или 5 процентный раствор иодистого натрия. Эти средства сохраняются в клинической практике и сегодня. Например, при запущенных формах заболевания перед назначением антибиотиков иногда проводится предварительное уничтожение возбудителя с помощью йодсодержащих препаратов. Их главное преимущество заключалось в меньшей токсичности по сравнению с соединениями ртути.
В 1908 году под руководством Пауля Эрлиха был синтезирован сальварсан (известный как «препарат 606»), представляющий собой производное арсенобензола с формулой C12H12O2N2As2. Этот препарат отличался высокой эффективностью, хотя количество побочных эффектов оставалось сопоставимым с ртутными средствами. Тем не менее, его успех обеспечил широкое распространение по всему миру.
Позднее были разработаны менее токсичные и более активные органические соединения мышьяка, такие как новарсенол и миарсенол. В 1921 году начали применять препараты висмута (бийохинол, бисмоверол, пентабисмол), которые, обладая несколько меньшей противосифилитической активностью, демонстрировали значительно меньше побочных эффектов. С 1930-х годов эти средства постепенно вытеснили ртуть и йод из арсенала терапии сифилиса и оставались в практике вплоть до 1990-х годов. Тем не менее, в некоторых случаях препараты висмута всё ещё используются.
Новый этап в лечении сифилиса начался в 1943 году с внедрением антибиотиков пенициллинового ряда. Они сочетали высокую эффективность против бледной трепонемы с минимальными побочными эффектами, характерными для препаратов солей тяжёлых металлов.
На сегодняшний день соли мышьяка и висмута практически полностью уступили место современным антибиотикам. Однако в редких случаях резистентности к антибиотикам препараты висмута (например, бийохинол) и мышьяка (миарсенол) всё ещё находят применение.
Особенностью бледной трепонемы является её способность к размножению только в узком температурном диапазоне — около 37 °C. Даже незначительное повышение температуры тела пациента существенно угнетает размножение возбудителя и частично уничтожает его. В третичной стадии сифилиса гипертермия замедляет развитие деструктивных процессов в органах и тканях.
Это явление легло в основу метода пиротерапии. В XIX–XX веках пациентов с сифилисом искусственно заражали лабораторным штаммом малярийного плазмодия, вызывая лихорадку с температурой до 40–41 °C. Хотя это не всегда приводило к полному излечению, оно существенно замедляло прогрессирование болезни. Сегодня этот метод не используется, но принцип пиротерапии остаётся актуальным в некоторых клинических случаях. Современный подход предполагает использование препарата Пирогенал для искусственного повышения температуры тела пациента.
Современные методы лечения
Бледная трепонема остаётся уникальным микроорганизмом, сохранившим высокую чувствительность к пенициллину и его производным даже после десятилетий активного применения этих препаратов. Она не продуцирует пенициллиназы и не обладает другими механизмами защиты, такими как мутации белков клеточной стенки или гены поливалентной лекарственной устойчивости, которые давно выработались у других патогенов. Именно поэтому основным методом лечения сифилиса по-прежнему является длительное систематическое использование производных пенициллина в достаточных дозах.
Альтернативные режимы терапии рекомендуются только при аллергии пациента на пенициллин или при подтверждённой резистентности штамма бледной трепонемы к этим препаратам. В таких случаях могут применяться эритромицин (другие макролиды теоретически также эффективны, но их использование официально не утверждено Минздравом), производные тетрациклина или цефалоспорины. Аминогликозиды способны подавлять размножение возбудителя только при крайне высоких дозах, которые оказывают токсическое воздействие на организм, поэтому их использование в качестве монотерапии не рекомендуется. Сульфаниламиды при лечении сифилиса полностью неэффективны.
При нейросифилисе лечение препаратами пенициллина требует сочетания перорального или внутримышечного введения антибиотиков с их эндолюмбальным введением, а также применения пиротерапии, которая повышает проницаемость гематоэнцефалического барьера. Однако в России лечение нейросифилиса препаратами пенициллинового ряда сталкивается с трудностями, связанными с необходимостью эндолюмбального введения, которое недоступно в большинстве дерматовенерологических учреждений из-за отсутствия специалистов, имеющих право на проведение данной процедуры. Это вынуждает привлекать к лечению учреждения общемедицинской сети. В некоторых случаях возможно использование антибиотиков других групп, способных преодолевать гематоэнцефалический барьер, например, цефалоспоринов. Однако в Российской Федерации применение альтернативных схем лечения ограничено процессуальными сложностями, установленными Минздравом.
При распространённом третичном сифилисе, когда бледная трепонема проявляет значительную устойчивость к антибактериальным препаратам, а состояние пациента позволяет использовать высокоактивные, но токсичные средства, может быть рекомендовано добавление к антибиотикам производных висмута (например, бийохинол) или соединений мышьяка (миарсенол, новарсенол). Эти препараты являются высокотоксичными, редко применяются и доступны только в ограниченных количествах для специализированных учреждений, так как отсутствуют в свободной продаже.
Лечение сифилиса обязательно включает терапию всех половых партнёров больного. При первичном сифилисе обследованию и лечению подлежат все лица, имевшие половые контакты с пациентом за последние три месяца. При вторичном сифилисе этот период увеличивается до одного года.